Hoger risico op verhoogde intra-oculaire druk bij gebruik Eylea voorgevulde spuit
Bij het gebruik van de Eylea voorgevulde spuit worden meer meldingen gedaan van verhoogde intra-oculaire druk (druk van de vloeistof in het oog). Deze verhoogde druk komt ongeveer zeven keer vaker voor dan bij toediening met een Luer-lock spuit gevuld met Eylea oplossing voor injectie uit een injectieflacon. De meest waarschijnlijke oorzaken van de gerapporteerde gevallen zijn verkeerde handelingen bij het voorbereiden en injecteren. Het CBG adviseert daarom de injecties uitsluitend door zorgverleners te laten uitvoeren die getraind zijn in het het gebruik van Eylea voorgevulde spuit.
Eylea 40 mg/ml (aflibercept oplossing voor intravitreale injectie) voorgevulde spuit wordt gebruikt voor de behandeling van de volgende oogaandoeningen bij volwassenen: neovasculaire (natte) leeftijdsgebonden maculadegeneratie (LMD) en verschillende vormen van visusverslechtering. Een intravitreale injectie is een injectie met geneesmiddel in het glasachtig lichaam van het oog.
Advies aan zorgverleners
- Het juiste gebruik van de voorgevulde spuit en training zijn belangrijk bij het beperken van dit risico:
- Gebruik bij toediening een 30G x ½ inch injectienaald;
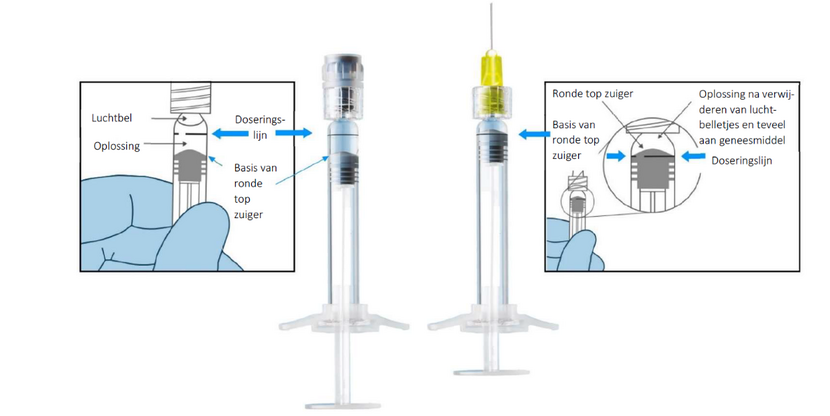
- Controleer altijd of het teveel aan geneesmiddel en luchtbelletjes in de voorgevulde spuit wordt verwijderd voor gebruik: de basis van de ronde top van de zuiger (niet de bovenkant van de ronde top) moet zich op één lijn bevinden met de zwarte doseringslijn op de spuit (zie figuur hieronder);
- Druk de zuiger voorzichtig in;
- Dien de exacte aanbevolen dosis toe en dien geen resterend geneesmiddel toe, aangezien teveel aan injectievolume kan leiden tot een klinisch relevante verhoogde intra-oculaire druk.
- Evalueer het zicht van de patiënt en controleer de intra-oculaire druk onmiddellijk na de injectie.
Brief met risico-informatie
De firma Bayer B.V. heeft over dit onderwerp een brief verstuurd, een zogenoemde Direct Healthcare Professional Communication (DHPC). De brief met deze belangrijke risico-informatie is in overleg met het College ter Beoordeling van Geneesmiddelen (CBG), Europese Medicijnagentschap EMA en de Inspectie Gezondheidszorg en Jeugd (IGJ) gestuurd naar de volgende zorgverleners: oogartsen, ziekenhuisapothekers, physician assistants werkzaam op afdelingen oogheelkunde en alle genoemde specialismen in opleiding.
Het signaleren en analyseren van bijwerkingen gedurende de gehele levenscyclus van een geneesmiddel wordt geneesmiddelenbewaking of farmacovigilantie genoemd. Dit is een kerntaak van het CBG. In geval van urgente en/of belangrijke veiligheidsissues worden medische beroepsbeoefenaren door middel van een DHPC op de hoogte gebracht.